Нанороботы, борющиеся с раком, запрограммированы на поиск и уничтожение опухолей
Изображение: Jason Drees, Arizona State University
В крупном исследовании в области наномедицины ученые Аризонского государственного университета (ASU) в сотрудничестве с исследователями из Национального центра нанонауки и технологии (NCNST) Академии наук Китая успешно запрограммировали нанороботы для сокращения опухолей путем отсечения их от притока крови.
«Мы разработали первую полностью автономную роботизированную систему ДНК для очень точного воздействия лекарств и целенаправленной терапии рака», — сказали Хао Янь, директор Центра молекулярного дизайна и биомиметики Института биотехнологии ASU Bioesign, и профессор Милтон Глик из Школе молекулярной медицины наук.
«Кроме того, эта технология является стратегией, которая может быть использована для борьбы со многими видами рака, поскольку все кровеносные сосуды, питающие опухоли, по существу одинаковы», — сказал Хао Янь.
Успешная демонстрация технологии, первое в своем роде исследование у млекопитающих с использованием моделей рака молочной железы, меланомы, яичников и легких, была опубликована в журнале Nature Biotechnology.
Найти и уничтожить
Хао Янь является экспертом в области ДНК-оригами, которая в последние два десятилетия существенно продвинулась в построения все более сложных структур наномасштаба, в тысячу раз меньшем, чем ширина человеческого волоса. Технология дает надежду на революцию в медицине.
И такая революция может случиться в один прекрасный день — может быть даже немного быстрее, чем ожидалось.
Наномедицина — это новая отрасль медицины, которая стремится сочетать обещание нанотехнологий открывать совершенно новые возможности для лечения, такие как наночастицы размером с молекулы, чтобы диагностировать и лечить сложные заболевания, особенно рак.
До сих пор проблема продвижения наномедицины была затруднена, потому что ученые хотели разработать, построить и тщательно контролировать нанороботы, чтобы активно искать и уничтожать раковые опухоли, не нанося вреда никаким здоровым клеткам в организме.
Международная команда исследователей преодолела эту проблему, используя, казалось бы, простую стратегию — очень избирательно искать и изолировать опухоли.
Эта работа была начата около 5 лет назад. Исследователи NCNST сначала захотели отключить кровоснабжение опухоли, вызвав коагуляцию крови с использованием ДНК-наноносителей. Опыт профессора Хао Яна помог модернизировать подход, чтобы сделать полностью программируемую роботизированную систему, которая способна выполнять свою миссию полностью самостоятельно.
«Наши нанороботы могут быть запрограммированы на транспортировку молекулярных полезных нагрузок и вызывают локальные закупорки кровеносных сосудов в конкретном месте, что может привести к гибели ткани и уменьшить опухоль», — сказал Баокуан Дин, профессор NCNST, расположенный в Пекине.
Чтобы выполнить свое исследование, ученые воспользовались известной моделью опухоли мышей, когда человеческие раковые клетки вводят в мышь, чтобы вызвать агрессивный рост опухоли.
Как только опухоль выросла, нанороботы были развернуты в организме, чтобы прийти на помощь.
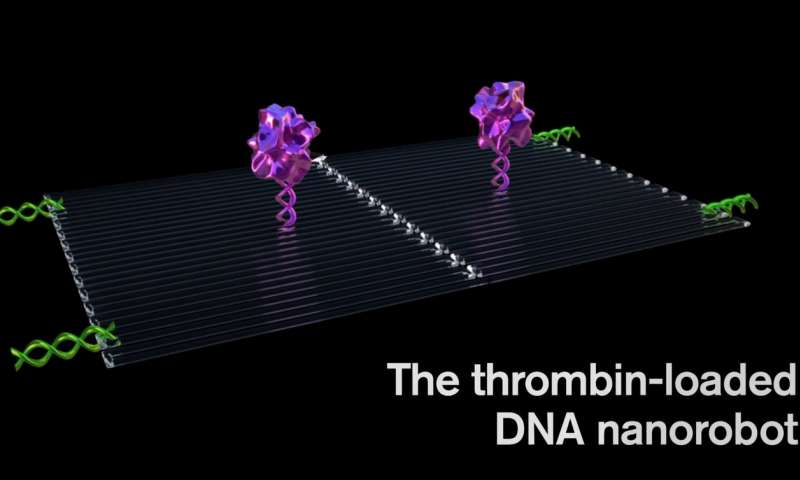
Каждый наноробот выполнен из плоского, прямоугольного листа ДНК-оригами, размером 90 на 60 нанометров. К поверхности прикрепляется ключевой кровянистый фермент, называемый тромбином.
Тромбин может блокировать кровоток в опухоли путем свертывания крови в сосудах, которые питают рост опухоли, вызывая у опухоли своего рода мини-сердечный приступ и приводя к гибели опухолевой ткани.
В среднем четыре молекулы тромбина были прикреплены к плоским каркасам ДНК. Затем плоский лист сворачивали, как лист бумаги, чтобы сделать полую трубку, похожую на цилиндр.
После чего, такие трубки-роботы вводили в мышь, а затем они путешествовали по всему кровотоку, перемещаясь к опухолям.
Ключ к программированию наноробота, который атакует только раковую клетку, включает специальную полезную нагрузку на поверхности, называемую аптамером ДНК. Аптамер ДНК может специфически нацеливаться на белок, называемый нуклеолин (ядрышковый белок), который производится в больших количествах только на поверхности эндотелиальных клеток опухоли и не находится на поверхности здоровых клеток.

Изображение: Jason Drees, Arizona State University
Закрепляясь на поверхности кровеносного сосуда, наноробот действует, как пресловутый троянский конь, чтобы доставить свой груз к опухоли, обнажая фермент под названием тромбин, который является ключом к свертыванию крови.
Далее нанороботы работают оперативно, собравшись в большом количестве, чтобы быстро окружить опухоль через несколько часов после инъекции.
Безопасный и надежный
В первую очередь, команда показала, что нанороботы были безопасными и эффективными в деле сокращении опухолей.
«Наноробот оказался безопасным и иммунологически инертным для использования у нормальных мышей, а также у бамских миниатюрных свиней, не обнаруживших заметных изменений в нормальной коагуляции крови или морфологии клеток», — сказал Юлиан Чжао, также профессор NCNST и ведущий научный сотрудник международной команды.
Самое главное, не было доказательств распространения нанороботов в мозг, где это могло вызвать нежелательные побочные эффекты, такие как инсульт.
«Нанороботы решительно безопасны в нормальных тканях мышей и крупных животных», — сказал Гуанджун Ни, еще один профессор NCNST и ключевой член совместной команды ученых.
Лечение блокировало кровоснабжение опухоли и вызывало повреждение опухолевой ткани в течение 24 часов, не влияя на здоровые ткани. После нападения на опухоль большинство нанороботов были очищены и выведены из организма через 24 часа.
Через два дня наблюдались признаки прогрессирующего тромбоза, а через 3 дня наблюдались тромбы во всех опухолевых сосудах.
Ключ состоит в том, чтобы вызвать тромбин только тогда, когда он находится внутри кровеносных сосудов опухоли. Кроме того, в модели мышиной меланомы 3 из 8 мышей, получавших терапию нанороботами, показали полную регрессию опухолей. Среднее время выживания более чем удвоилось, от 20,5 до 45 дней.
Ученые также пробовали свою систему в тесте на первичную модель рака легкого у мышей, которая имитирует клинический курс пациентов с раком легких. Они показали усадку опухолевых тканей после двухнедельного лечения.
Нанороботы могут многое
«Наноробот ДНК для доставки тромбина представляет собой значительный прогресс в применении ДНК-нанотехнологий для лечения рака», — говорит Хао Янь. «В модели мышиной меланомы наноробот не только затрагивал первичную опухоль, но и предотвращал образование метастазов, демонстрируя перспективный терапевтический потенциал».
Хао Янь и его сотрудники в настоящее время активно проводят клинические испытания для дальнейшего развития этой технологии.
«Я думаю, что мы стали гораздо ближе к реальным практическим медицинским применениям нанотехнологии», — говорит Хао Янь. «Комбинации различных рационально разработанных нанороботов, несущих разные агенты, могут помочь достичь конечной цели в лечении рака: искоренение твердых опухолей и васкуляризированных метастазов. Кроме того, нынешняя стратегия может быть разработана как платформа доставки лекарств для лечения других заболеваний».
Больше информации: A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo, Nature Biotechnology (2018). nature.com/articles/doi:10.1038/nbt.4071