Биологический словарь
ИММУНОГЛОБУЛИНЫ
ИММУНОГЛОБУЛИНЫ
Ig, антитела, сложные белки (гликопротеиды), к-рые специфически связываются с чужеродными веществами — антигенами; гл. эффекторные молекулы гуморального иммунитета. Содержатся в глобулиновой фракции сыворотки крови, в лимфе (циркулирующие антитела), в молозиве, слюне (секреторные антитела) и на поверхности клеток (связанные с мембраной антитела). Молекула мономерного И. образована 4 полипептидными цепями: 2 одинаковыми «лёгкими», или L-цепями (мол. м. ок. 25 000), и 2 одинаковыми «тяжёлыми», или Н-цепями (мол. м. 50 000—70 000). Каждая цепь имеет вариабельную по аминокислотным остаткам (СОН2-концевую) и постоянную (СООН-концевую) части. Вариабельные части L- и Н-цепей образуют активный центр, или паратоп (полость особой конфигурации, по размерам и структуре соответствующую детерминантным группам антигена), к-рый определяет способность антитела специфически (комплементарно) связываться с антигеном. Молекула мономерного И. имеет 2 активных центра одинаковой специфичности. Множеств, аминокислотные замены в вариабельных частях L- и Н-цепей создают неисчерпаемый набор активных центров, способных специфически связываться с любой природной или искусственно синтезир. антигенной детерминантой. Тяжёлые и лёгкие цепи И. примерно через каждые 110 аминокислотных остатков образуют стянутые внутрицепочеч-ными дисульфидными связями петли, каждая из к-рых складывается в клубок — домен; молекула мономерного И. имеет 2 вариабельных и 4—5 постоянных доменов. Домены попарно формируют компактные глобулы. Между 2-м и 3-м доменами расположена «шарнирная область» из 15—60 аминокислотных остатков, среди к-рых много остатков полу-цистина и пролина — место наибольшей «подвижности» и «обнажённости» в молекуле. Именно здесь разл. протеолитич. ферменты расщепляют И., напр. папаин даёт 2 Fab-фрагмента (сохраняющих способность связываться с антигеном) и Fc-фрагмент (определяющий прохождение антител через мембраны, способность связывать комплемент и фиксироваться на клетках). Все фрагменты в составе молекулы И.
обладают определ. свободой вращения относительно друг друга вокруг «шарнира». L- и Н-цепи синтезируются на полирибосомах плазматич. клеток (см. ИММУНОЦИТЫ). Каждая из цепей транслируется с мРНК, к-рая считывается с 2 разных групп генов, кодирующих вариабельные домены (V-гены), и с сегментов ДНК, кодирующих постоянные домены (С-гены). Цепи объединяются в молекулу на мембранах эндоплазматич. сети. У млекопитающих И. относятся к 5 классам (IgG, IgM, IgA, IgD, IgE), различающимся по антигенным свойствам своих . Н-цепей, структуре (мономерные, полимерные), мол. массе, содержанию углеводов и, главное, по функции. У человека: IgG — осн. эффекторные молекулы иммунитета (проходят через плаценту); IgM — эффекторные молекулы раннего противоинфекционного ответа, рецепторы В-лимфоцитов; IgA — эффекторы местного иммунитета на слизистых оболочках и в секретах слюнных, слёзных и молочных желёз; IgD — рецепторы В-лимфоцитов; IgE — реагины, эффекторы аллергии и противопаразитар-ного иммунитета. В филогенезе антите-лоподобные белки появляются уже у кольчатых червей, моллюсков, членистоногих, но антитела характерного строения впервые обнаруживаются лишь у низших позвоночных (миног и миксин) одновременно с закладкой тимуса и примитивной селезёнки. И., связанные с поверхностной мембраной лимфоцитов, а также секреторные И. появляются у хрящевых и костистых рыб, в частности у акул. У этих же животных имеются плазматич. клетки, синтезирующие И. Разделение И. на классы происходит у двоякодышащих рыб (IgM, IgN), земноводных и пресмыкающихся (IgM, IgG), птиц (IgM, Igl, IgA, секреторный slgA). Препараты специфич. антител (т. н. иммунные сыворотки) широко используют для диагностики, предупреждения, лечения инфекц. заболеваний (антитоксич. сыворотки, гамма-глобулины). Антитела — осн. реагент иммунохимич. анализа, используемого в разл. областях биологии для выявления антигенов. (см. ИММУНИТЕТ, АНТИГЕНЫ).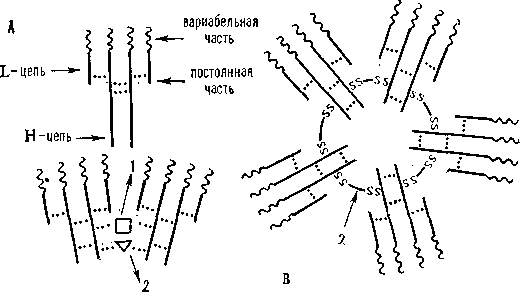 Схемы строения молекул иммуноглобулинов: А — мономерных (IgG. IgE, IgD, IgA); Б — полимерных (slgA) и В (IgM); 1 — секреторный компонент; 2 — соединительная цепь.
Схемы строения молекул иммуноглобулинов: А — мономерных (IgG. IgE, IgD, IgA); Б — полимерных (slgA) и В (IgM); 1 — секреторный компонент; 2 — соединительная цепь.
Ig, антитела, сложные белки (гликопротеиды), к-рые специфически связываются с чужеродными веществами — антигенами; гл. эффекторные молекулы гуморального иммунитета. Содержатся в глобулиновой фракции сыворотки крови, в лимфе (циркулирующие антитела), в молозиве, слюне (секреторные антитела) и на поверхности клеток (связанные с мембраной антитела). Молекула мономерного И. образована 4 полипептидными цепями: 2 одинаковыми «лёгкими», или L-цепями (мол. м. ок. 25 000), и 2 одинаковыми «тяжёлыми», или Н-цепями (мол. м. 50 000—70 000). Каждая цепь имеет вариабельную по аминокислотным остаткам (СОН2-концевую) и постоянную (СООН-концевую) части. Вариабельные части L- и Н-цепей образуют активный центр, или паратоп (полость особой конфигурации, по размерам и структуре соответствующую детерминантным группам антигена), к-рый определяет способность антитела специфически (комплементарно) связываться с антигеном. Молекула мономерного И. имеет 2 активных центра одинаковой специфичности. Множеств, аминокислотные замены в вариабельных частях L- и Н-цепей создают неисчерпаемый набор активных центров, способных специфически связываться с любой природной или искусственно синтезир. антигенной детерминантой. Тяжёлые и лёгкие цепи И. примерно через каждые 110 аминокислотных остатков образуют стянутые внутрицепочеч-ными дисульфидными связями петли, каждая из к-рых складывается в клубок — домен; молекула мономерного И. имеет 2 вариабельных и 4—5 постоянных доменов. Домены попарно формируют компактные глобулы. Между 2-м и 3-м доменами расположена «шарнирная область» из 15—60 аминокислотных остатков, среди к-рых много остатков полу-цистина и пролина — место наибольшей «подвижности» и «обнажённости» в молекуле. Именно здесь разл. протеолитич. ферменты расщепляют И., напр. папаин даёт 2 Fab-фрагмента (сохраняющих способность связываться с антигеном) и Fc-фрагмент (определяющий прохождение антител через мембраны, способность связывать комплемент и фиксироваться на клетках). Все фрагменты в составе молекулы И.
обладают определ. свободой вращения относительно друг друга вокруг «шарнира». L- и Н-цепи синтезируются на полирибосомах плазматич. клеток (см. ИММУНОЦИТЫ). Каждая из цепей транслируется с мРНК, к-рая считывается с 2 разных групп генов, кодирующих вариабельные домены (V-гены), и с сегментов ДНК, кодирующих постоянные домены (С-гены). Цепи объединяются в молекулу на мембранах эндоплазматич. сети. У млекопитающих И. относятся к 5 классам (IgG, IgM, IgA, IgD, IgE), различающимся по антигенным свойствам своих . Н-цепей, структуре (мономерные, полимерные), мол. массе, содержанию углеводов и, главное, по функции. У человека: IgG — осн. эффекторные молекулы иммунитета (проходят через плаценту); IgM — эффекторные молекулы раннего противоинфекционного ответа, рецепторы В-лимфоцитов; IgA — эффекторы местного иммунитета на слизистых оболочках и в секретах слюнных, слёзных и молочных желёз; IgD — рецепторы В-лимфоцитов; IgE — реагины, эффекторы аллергии и противопаразитар-ного иммунитета. В филогенезе антите-лоподобные белки появляются уже у кольчатых червей, моллюсков, членистоногих, но антитела характерного строения впервые обнаруживаются лишь у низших позвоночных (миног и миксин) одновременно с закладкой тимуса и примитивной селезёнки. И., связанные с поверхностной мембраной лимфоцитов, а также секреторные И. появляются у хрящевых и костистых рыб, в частности у акул. У этих же животных имеются плазматич. клетки, синтезирующие И. Разделение И. на классы происходит у двоякодышащих рыб (IgM, IgN), земноводных и пресмыкающихся (IgM, IgG), птиц (IgM, Igl, IgA, секреторный slgA). Препараты специфич. антител (т. н. иммунные сыворотки) широко используют для диагностики, предупреждения, лечения инфекц. заболеваний (антитоксич. сыворотки, гамма-глобулины). Антитела — осн. реагент иммунохимич. анализа, используемого в разл. областях биологии для выявления антигенов. (см. ИММУНИТЕТ, АНТИГЕНЫ).
 Схемы строения молекул иммуноглобулинов: А — мономерных (IgG. IgE, IgD, IgA); Б — полимерных (slgA) и В (IgM); 1 — секреторный компонент; 2 — соединительная цепь.
Схемы строения молекул иммуноглобулинов: А — мономерных (IgG. IgE, IgD, IgA); Б — полимерных (slgA) и В (IgM); 1 — секреторный компонент; 2 — соединительная цепь.
.(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)иммуноглобули́ны
белки, обладающие активностью антител.
белки, обладающие активностью антител.
.(Источник: «Биология. Современная иллюстрированная энциклопедия.» Гл. ред. А. П. Горкин; М.: Росмэн, 2006.)