Микробиологи раскрыли структуру и функцию белкового комплекса LPD-3
Новое исследование, проведенное Университетом здравоохранения и науки Орегона раскрыло детали структурной организации и белкового состава комплекса переноса липидов LPD-3, относящегося к группе мостовидных белков переноса липидов (BLTP). Результаты, опубликованные в журнале Nature, проливают свет на механизмы массового транспорта липидов между клеточными мембранами, что имеет ключевое значение для понимания клеточной биологии и патогенеза связанных заболеваний.
Структурная организация LPD-3 и механизм переноса липидов
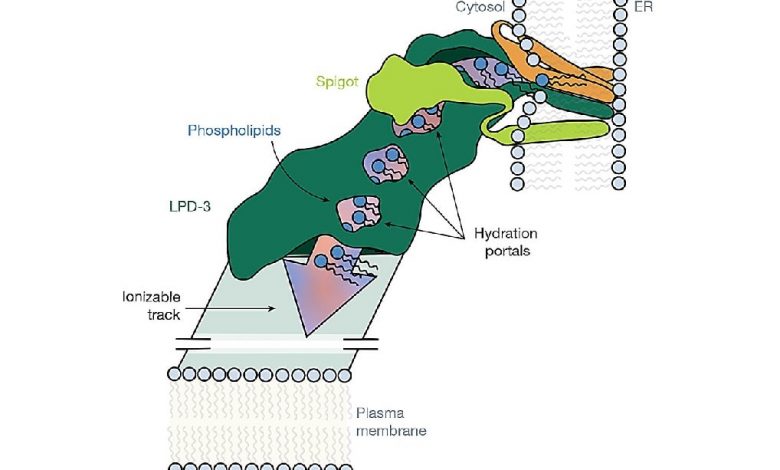
LPD-3 представляет собой крупный белковый комплекс, образующий протяженную туннелеподобную структуру длиной 345 ангстрем. Внутренний канал LPD-3 выстлан гидрофобными участками и содержит 27 молекул липидов, расположенных с интервалом около 8,4 ангстрем, что соответствует их естественному распределению в мембранных бислоях. Этот туннель также включает три дополнительных фосфолипида в трансмембранном домене.
Важной особенностью является наличие ионизируемых остатков (кислых и основных) вдоль всего канала, формирующих заряженный трек, а также четырех гидратированных порталов, обеспечивающих доступ воды к полярным головкам липидов. Такая организация предполагает, что LPD-3 функционирует как динамическая система, облегчающая массовый перенос липидов между органеллами, такими как эндоплазматический ретикулум (ЭР) и другие мембранные структуры.
Вспомогательные белки и их роль
Масс-спектрометрический анализ выявил два ключевых белка, ассоциированных с LPD-3: Spigot (консервативный среди разных видов) и вспомогательный белок переноса липидов 2 (LTAP2). Spigot взаимодействует с N-концевой областью LPD-3, а его нокдаун в модельных организмах (C. elegans, Drosophila, клетки HeLa) приводит к значительным нарушениям в организации мембран и клеточных процессах, таких как фагоцитоз и формирование контактов ЭР–плазматическая мембрана. LTAP2 также демонстрирует эволюционную консервативность, но его точная локализация в структуре LPD-3 осталась неопределенной. Кроме того, был обнаружен третий компонент — трехспиральный трансмембранный пучок, чья функция требует дальнейшего изучения.
Методология исследования
Для выделения и анализа LPD-3 исследователи использовали трансгенных нематод Caenorhabditis elegans с флуоресцентными и эпитопными метками. Очистка комплекса потребовала обработки около 60 миллионов червей, что подчеркивает техническую сложность работы с такими крупными белковыми системами. Структурные данные были получены с помощью криогенной электронной микроскопии (крио-ЭМ), хотя разрешение С-концевой области оказалось ограниченным из-за структурной гетерогенности. Дополнительно применялась масс-спектрометрия для идентификации пептидов и подтверждения состава комплекса.
Клиническое значение и перспективы
Мутации в гене BLTP1 (человеческий аналог LPD-3) ассоциированы с синдромом Алкурая-Кучинскаса — тяжелым неврологическим расстройством, характеризующимся задержкой развития, эпилепсией и другими нарушениями. Полученные структурные данные предоставляют основу для изучения молекулярных механизмов этого заболевания. Понимание того, как LPD-3 организует перенос липидов, открывает возможности для разработки терапевтических стратегий, направленных на коррекцию дисфункций, связанных с BLTP.
Это исследование впервые детально описывает архитектуру и функциональные компоненты комплекса LPD-3, предлагая модель объемного переноса липидов через туннелеподобную структуру. Результаты не только углубляют понимание клеточного липидного обмена, но и создают фундамент для изучения связанных патологий. Дальнейшие исследования могут быть сосредоточены на уточнении роли вспомогательных белков и разработке методов модуляции активности BLTP в терапевтических целях.