Биологи СПбГУ выяснили, почему сальмонелла по‑разному заражает животных, насекомых и растения
Ученые Санкт‑Петербургского университета вместе с коллегами из других научных организаций изучили геномы и белки, связанные с вирулентностью, то есть их способностью заражать организмы, у нескольких родов энтеробактерий: Escherichia, Salmonella и Serratia. Биологи выявили гены, благодаря которым энтеробактерии по‑разному взаимодействуют с различными организмами. Несмотря на то, что большинство энтеробактерий известны как патогены человека и животных, некоторые из них могут влиять на растения — например, приводить к их усиленному росту.
Энтеробактерии — это семейство бактерий, некоторые представители которого способны жить в кишечнике и других органах людей и животных. В зависимости от конкретных видов и штаммов микроорганизмов они могут быть как компонентами нормальной микрофлоры, так и патогенами, вызывающими различные заболевания, например кишечные инфекции.
Ученые Санкт‑Петербургского университета, Всероссийского научно‑исследовательского института сельскохозяйственной микробиологии (ВНИИСХМ), Института цитологии РАН и Института теоретической и экспериментальной биофизики описали четыре новых амилоидных белка у энтеробактерий родов Escherichia и Salmonella. Белки OmpC и OmpF этих энтеробактерий в своем обычном состоянии работают как поры наружной мембраны бактериальных клеток, обеспечивающие транспортировку различных веществ. Как показал коллектив исследователей, эти белки также способны образовывать токсичные для клеток млекопитающих амилоидные фибриллы.
Биологи СПбГУ выяснили, что эти фибриллы могут возникать не только в пробирке, но и in vivo, то есть непосредственно клетками энтеробактерий. В 2020 году ученые Санкт‑Петербургского университета Антон Нижников и Кирилл Антонец стали лауреатами премии президента РФ в области науки и инноваций для молодых ученых за открытие амилоидных белков у растений и симбиотических бактерий. Исследования амилоидных белков энтеробактерий продолжают работы авторского коллектива, посвященные функциональным амилоидам прокариот и эукариот.
«Амилоиды — это особая форма белков, в которой отдельные молекулы слипаются между собой, формируя длинные нити. Накопление таких амилоидов связано с развитием целого ряда преимущественно неизлечимых заболеваний у животных и человека, например болезни Паркинсона или Альцгеймера. У бактерий тоже есть амилоиды, однако они являются функциональными — помогают бактериальным клеткам формировать биопленки, бороться с поверхностным натяжением среды, запасать токсины. А вот для организма‑хозяина (например, млекопитающих) бактериальные амилоиды могут быть вредными, поскольку помогают патогену выживать внутри хозяина и являются токсичными», — рассказал руководитель исследований амилоидных белков энтеробактерий, и. о. заведующего кафедрой генетики и биотехнологии СПбГУ, заведующий лабораторией ВНИИСХМ профессор РАН Антон Нижников.
Первый автор работы по амилоидным белкам энтеробактерий, научный сотрудник кафедры генетики и биотехнологии СПбГУ, старший научный сотрудник ВНИИСХМ Михаил Белоусов пояснил, что сверхэкспрессия белков OmpC или OmpF, то есть их повышенное производство бактериальными клетками, приводит к образованию амилоидов, устойчивых к действию ферментов желудочно‑кишечного тракта и различных химических веществ, разрушающих белки.
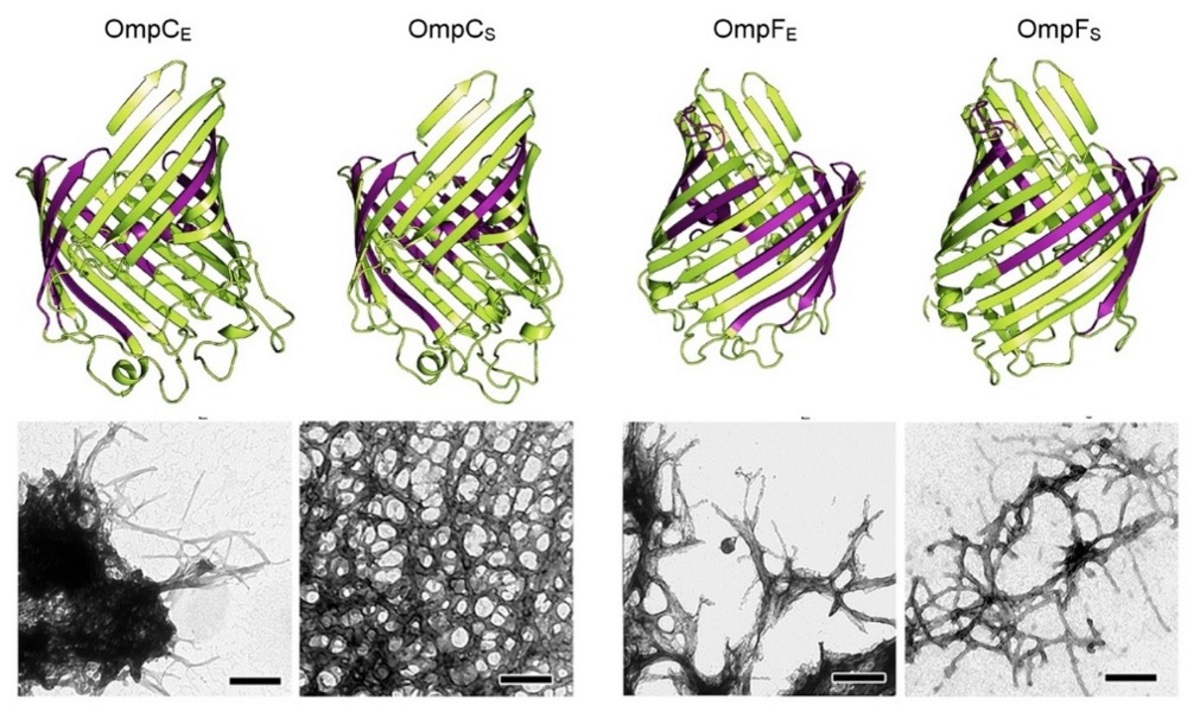
«Амилоидные фибриллы токсичны и, оказавшись в желудочно‑кишечном тракте, потенциально могут способствовать развитию заболеваний, вызываемых энтеробактериями, таких как сальмонеллез или брюшной тиф. Результаты нашего исследования свидетельствуют в пользу возможности патогенеза, опосредованного амилоидами белков наружной мембраны бактерий», — заключил профессор РАН Антон Нижников.
Как объяснил Антон Нижников, некоторые энтеробактерии заражают не только животных, но и другие организмы. Так, различные штаммы бактерии Serratia marcescens могут быть патогенными для насекомых и оказывать различное влияние, включая благоприятное, даже на растения. Все эти удивительные способности бактерии закодированы в ее геноме.
В рамках научной работы, опубликованной в журнале Frontiers in Microbiology, ученые Санкт‑Петербургского университета и Всероссийского научно‑исследовательского института сельскохозяйственной микробиологии также изучили факторы, которые влияют на заражение организмов бактерией Serratia marcescens. Оказалось, что бактерия задействует разные механизмы развития инфекции в зависимости от хозяина. Например, для заражения насекомых бактерия использует ферменты гидролазы и изохорисматазы и ферменты, осуществляющие нейротоксическое действие на насекомых. При заражении растений бактерия применяет системы секреции типа VI для выброса в клетку хозяина ферментов, ингибирующих синтез клеточной стенки, что позволяет им проникнуть внутрь хозяина.
Кроме того, с помощью пангеномного анализа биологи обнаружили гены, которые определяют способность некоторых штаммов этой бактерии проявлять не только вредоносные, но и полезные свойства, например способствовать росту растений или защищать их от загрязнителей. Как объяснил руководитель пангеномного исследования, ведущий научный сотрудник СПбГУ (кафедра цитологии и гистологии) и ВНИИСХМ Кирилл Антонец, пангеномика бактерий как метод позволяет анализировать сразу все гены, присутствующие в конкретной группе бактерий. Такой подход позволяет понять, как бактерии взаимодействуют с окружающей средой, выбирают хозяев и как именно могут вызывать болезни.
«Пангеномика позволяет проанализировать отличия всех секвенированных геномов, а их у бактерий могут быть тысячи и даже сотни тысяч в зависимости от степени изученности. Каждый геном кодирует тысячи белков в каждой конкретной бактерии — это огромные объемы данных. Совокупность этих белков для каждого бактериального штамма определяет, какие организмы бактерия будет поражать и какими свойствами обладает. Таким образом, в результате пангеномного исследования достаточно прочитать геном бактериального изолята и сказать, является ли он патогеном или полезной бактерией», — объяснил Кирилл Антонец.
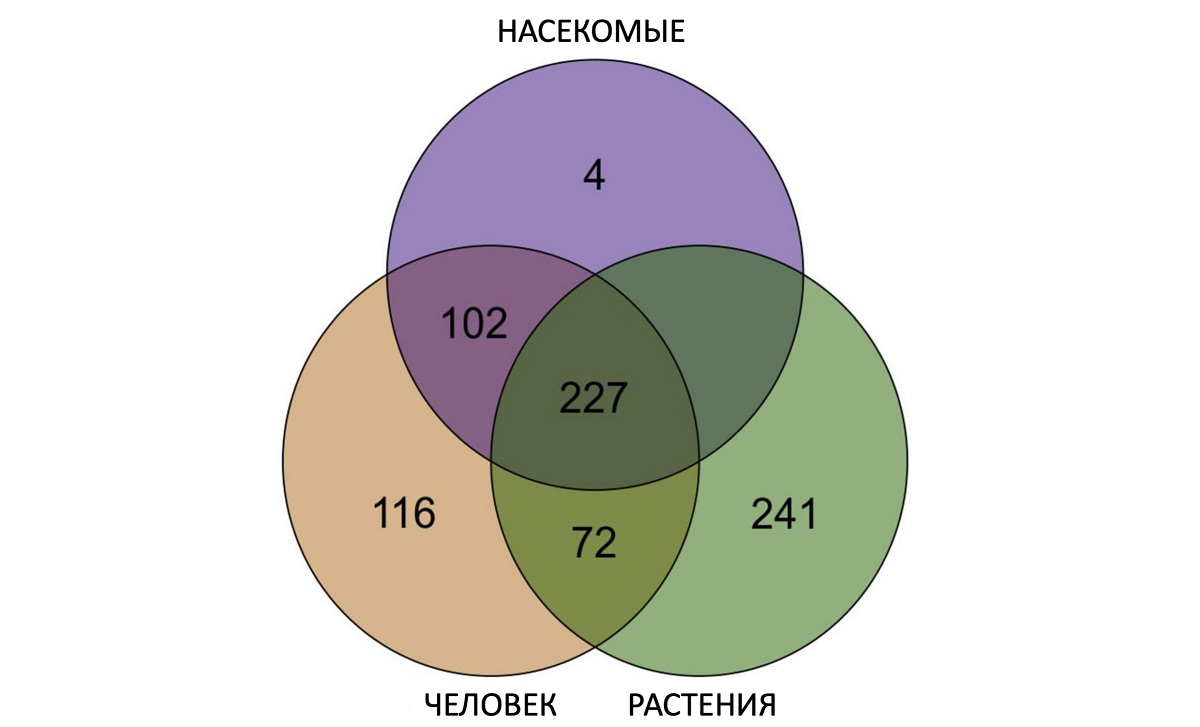
Используя пангеномный анализ бактерий, ученые СПбГУ определили, что Serratia marcescens может приспосабливаться к внутриклеточной среде хозяина благодаря способности включать различные гены вирулентности. При этом большинство этих генов не являются специфичными для штаммов, инфицирующих какого‑то одного хозяина.
В ходе исследования ученые также обнаружили ранее не изученные гены, которые могут быть ответственными за адаптацию бактерии к конкретным группам хозяев и определять как характер протекания инфекции, так и наличие потенциально выгодных для хозяев свойств. По словам первого автора пангеномного исследования, аспиранта СПбГУ, младшего научного сотрудника ВНИИСХМ Антона Шикова, результаты проведенного исследования помогут предсказывать болезнетворные или полезные свойства бактерий, что имеет существенную значимость для современной медицины и сельского хозяйства. Например, используя последовательности выявленных генов, можно оценить эпидемиологическую безопасность бактериальных изолятов или отобрать штаммы, которые впоследствии можно использовать в биотехнологии и сельском хозяйстве.