Раскрыто раннее происхождение болезни Гентингтона
С новыми выводами ученые готовы преодолеть тупик в исследованиях болезни Гентингтона, смертельного наследственного расстройства, для которого в настоящее время нет лечения.
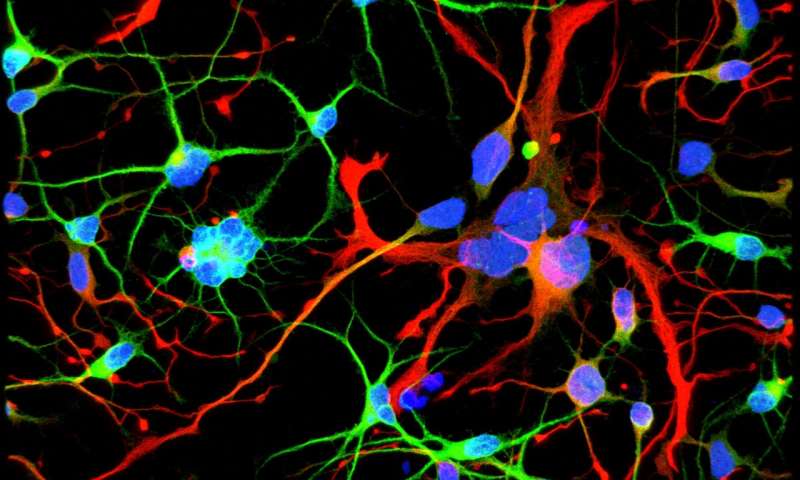
Примерно один из 10 000-20 000 человек страдает от этой болезни, и у большинства начинают проявлять симптомы в среднем возрасте, когда могут появляться отрывистые непроизвольные движения мыщц (гиперкинезы), и поскольку такие пациенты все чаще теряют мозговые нейроны, они впадают в деменцию. Но новое исследование предполагает, что эти симптомы могут быть поздним проявлением болезни, которая возникает гораздо раньше, на первых этапах эмбрионального развития.
Команда ученых во главе с Али Бриванлоу, профессорами Робертом и Харриет Хейльбрунн, разработала систему для моделирования Хантингтона в эмбриональных стволовых клетках человека. В отчете, опубликованном в «Development», они описывают ранние аномалии в отношении того, как выглядят нейроны Хантингтона, и как эти клетки образуют более крупные структуры, которые ранее не были связаны с этим заболеванием.
«Наши исследования подтверждают идею о том, что первое возникновение причин болезни может начинаться сразу после оплодотворения, — говорит Бриванл. Активная фаза наступает через десятилетия после рождения, когда симптомы начинают наблюдаться».
Полученные результаты влияют на то, как наилучшим образом подходить к лечению расстройства и в конечном итоге могут привести к эффективным методам лечения.
Новый инструмент
Гентингто является одним из немногих заболеваний с прямым генетическим виновником: у ста процентов людей с мутированной формой гена Huntingtin (HTT) развиваются эта болезнь. Мутация принимает форму дополнительной ДНК и заставляет ген продуцировать более длинный, чем обычно, белок. Сама ДНК появляется в форме повторяющейся последовательности, и чем больше повторений в ней есть, тем раньше начинается заболевание.
Исследования по болезни Гентингтона до сих пор в значительной степени основывались на моделях болезни у животных и оставляли многие ключевые вопросы без ответа. Например, ученые не могли решить, какую функцию обычно играет ген HTT, или как его мутация создает проблемы в мозге.
Подозревая, что болезнь работает по-разному у людей, чей мозг намного больше и сложнее, чем у лабораторных животных, Бриванлу, наряду с научными сотрудниками Альбертом Рузо и Гистом Крофом, разработал клеточную человеческую систему для своих исследований. Они использовали технологию редактирования генов CRISPR для разработки серии линий эмбриональных стволовых клеток человека, которые были идентичны, кроме числа повторов ДНК, которые происходили на концах их HTT-генов.
«Мы начали видеть вещи, которые были совершенно неожиданными, — говорит Бриванлу. «В клеточных линиях с мутантным HTT мы видели гигантские клетки. Это выглядело как настоящие джунгли дезорганизации».
Когда клетки делятся, они, как правило, сохраняют одно ядро. Однако некоторые из этих расширенных, мутировавших клеток имели до 12 ядер, что указывало на то, что был затронут нейрогенез или генерация новых нейронов. Нарушение было прямо пропорционально количеству повторов, присутствующих в мутации в гене: чем больше повторений было, тем больше многоядерных нейронов.
«Наша работа добавляет доказательства того, что в патологии существует непризнанный аспект развития», — говорит Бриванлу. «Гентингтон, возможно, не просто нейродегенеративное заболевание, но также и заболевание неврологическое».
Лечение болезни Гентингтона обычно фокусировалось на блокировании активности мутантного HTT-белка, предполагая, что измененная форма белка была более активной, чем обычно, и поэтому токсична для нейронов. Тем не менее, работа Бриванлу показывает, что нарушение в работе мозга может быть связано с отсутствием активности HTT-белка.
Чтобы проверить свою функцию, исследователи создали клеточные линии, которые полностью не содержали HTT-белок. Эти клетки оказались очень похожими на те, которые связаны с патологией Гентингтона, подтверждая мысль о том, что недостаток белка, а не его избыток, приводит к заболеванию.
Выводы значительны, отмечает Бриванлу, поскольку они показывают, что существующие методы лечения, предназначенные для блокирования активности HTT, на самом деле могут принести больше вреда, чем пользы.
«Мы должны пересмотреть наш подход к лечению болезни Гентингтона, — говорит он. «И роль протеина HTT, и время лечения должны быть пересмотрены, к тому времени, когда пациент проявляет симптомы, может быть слишком поздно его лечить. Нам нужно вернуться к самым ранним событиям, которые вызывают цепную реакцию, которая в конечном итоге приводит к болезни, поэтому мы можем сосредоточить новые методы лечения на причинах, а не на последствиях болезни».
Исследователи надеются, что их новые клеточные линии станут полезным ресурсом для изучения клеточных и молекулярных тонкостей Гентингтона и предполагают, что они могут служить моделью для изучения других заболеваний головного мозга, которые являются специфическими для человека.