Ученые создали сложные трансмембранные белки с нуля
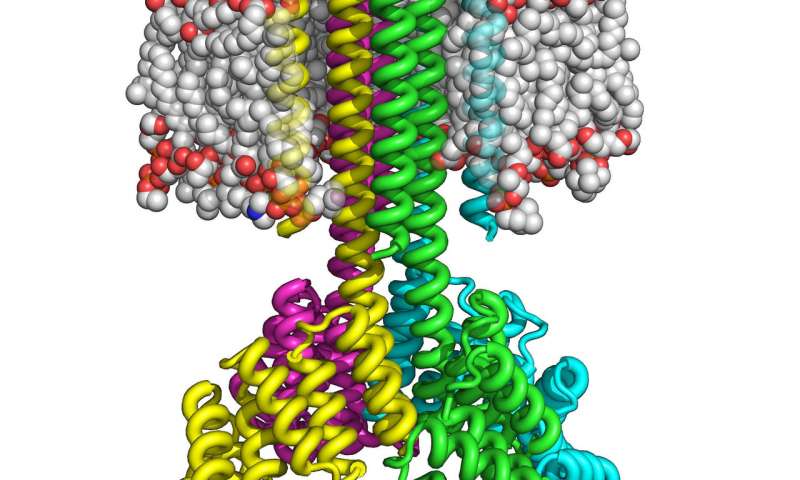
Изображение: University of Washington Institute for Protein Design
Теперь можно создавать сложные, специально разработанные трансмембранные белки с нуля, сообщают ученые. Исследование, проведенное молекулярными инженерами из Университета «Washington Institute for Protein Design», позволит исследователям создавать трансмембранные белки, не встречающиеся в природе, для выполнения конкретных задач.
В живом мире трансмембранные белки обнаружены в мембране всех клеток и клеточных органелл. Они необходимы для нормальной работы. Например, многие естественные трансмембранные белки действуют как шлюзы для перемещения конкретных веществ через биологическую мембрану. Некоторые трансмембранные белки принимают или передают сигналы клеток. Из-за таких ролей многие препараты предназначены для нацеливания трансмембранных белков и изменения их функций.
«Наши результаты прокладывают путь для разработки мембранных белков, которые могут имитировать протеины, обнаруженные в природе, или иметь совершенно новую структуру, функцию и использование», — сказал Дэвид Бейкер, профессор биохимии, который возглавлял проект. Исследование публикуется в номере журнала Science за 1 марта. Пейлонг Лу, старший научный сотрудник лаборатории Baker, является ведущим автором статьи.
Но понимание того, как трансмембранные белки объединяются и как они работают, оказалось сложным. Поскольку они действуют, будучи встроенными в клеточную мембрану, трансмембранные белки оказались более трудными для изучения, чем белки, которые действуют в водном растворе, которые составляют цитоплазму клеток или внеклеточную жидкость.
В новом исследовании Лу и его коллеги использовали компьютерную программу, разработанную в лаборатории Бейкера и названную Rosetta, которая может предсказать структуру, в которую белок будет складываться после того, как он был синтезирован. Архитектура белка имеет решающее значение, так как структура белка определяет его функцию.
Форма белка образуется из сложных взаимодействий между аминокислотами, составляющими белковую цепь, и взаимодействий между аминокислотами и окружающей средой. В конечном счете, белок принимает форму, которая наилучшим образом уравновешивает все эти факторы, так что белок достигает наименьшего возможного энергетического состояния.
Программа Rosetta, используемая Лу и его коллегами, может предсказать структуру белка, принимая во внимание эти взаимодействия и рассчитывая самое низкое общее энергетическое состояние. Она создает десятки тысяч модельных структур для аминокислотной последовательности, а затем идентифицирует те, которые имеют низкое энергетическое состояние.
Определение структуры трансмембранных белков затруднено, потому что части трансмембранных белков должны проходить через внутреннюю часть мембраны, которая состоит из жиров, называемых липидами.
В водных жидкостях аминокислотные остатки, которые имеют полярные боковые цепи — компоненты, которые могут иметь заряд в определенных физиологических условиях или которые участвуют в водородных связывания, как правило, расположены на поверхности белка, где они могут взаимодействовать с водой, которая имеет отрицательные и положительно заряженные стороны его молекулы. В результате полярные остатки на белках называются гидрофильными или «водолюбивыми».
С другой стороны, неполярные остатки, как правило, находятся в пределах ядра белка. Такие остатки называются гидрофобными. В результате, взаимодействие между водолюбивыми и водоудерживающими остатками белка и окружающих водных жидкостей помогает сгибать белки и стабилизирует окончательную структуру белка.
Однако в мембранах сложность белка больше, поскольку внутренняя поверхность липидов мембраны неполярна, то есть она не имеет разделения электрических зарядов. Это означает, что белок должен быть устойчивым, и на его поверхности должны быть размещены неполярные, опасные для воды остатки, а полярные должны быть внутри. Затем нужно найти способ стабилизировать структуру, создав связи между гидрофильными остатками в ядре.
Ключом к решению проблемы, говорит Лу, было применение метода, разработанного лабораторией Бейкера для создания белков, чтобы полярные, гидрофильные остатки действовали таким образом, чтобы было достаточно сформировать полярно-полярные взаимодействия, которые могли бы связать белок вместе изнутри.
«Объединение этих «замкнутых сетей водородной связи» было похоже на сборку головоломки с пистолетом», — сказал Бейкер.
При таком подходе Лу и его коллеги смогли изготовить сконструированные трансмембранные белки внутри бактерий и клеток млекопитающих с использованием всего 215 аминокислот. Полученные белки оказались очень термически стабильными и способными правильно ориентироваться на мембране. Подобно природным трансмембранным белкам, эти белки являются многопроходными, то есть они несколько раз пересекают мембрану и собираются в стабильные многобелковые комплексы, такие как димеры, тримеры и тетрамеры.
«Мы показали, что теперь можно точно сконструировать сложные, многопроходные трансмембранные белки, которые могут находится в клетках, что позволит исследователям создавать трансмембранные белки с совершенно новыми структурами и функциями», — сказал Пейлонг Лу.
Больше информации: «Accurate computational design of multipass transmembrane proteins» Science (2018). DOI: 10.1126/science.aaq1739