Ученые СПбГУ нашли способ для распознавания спектральных сигналов амилоидных фибрилл
Исследователи СПбГУ создали новую теорию диффузионных экспериментов ЯМР для изучения амилоидных фибрилл — ключевых факторов, провоцирующих различные формы деменции, включая болезнь Альцгеймера
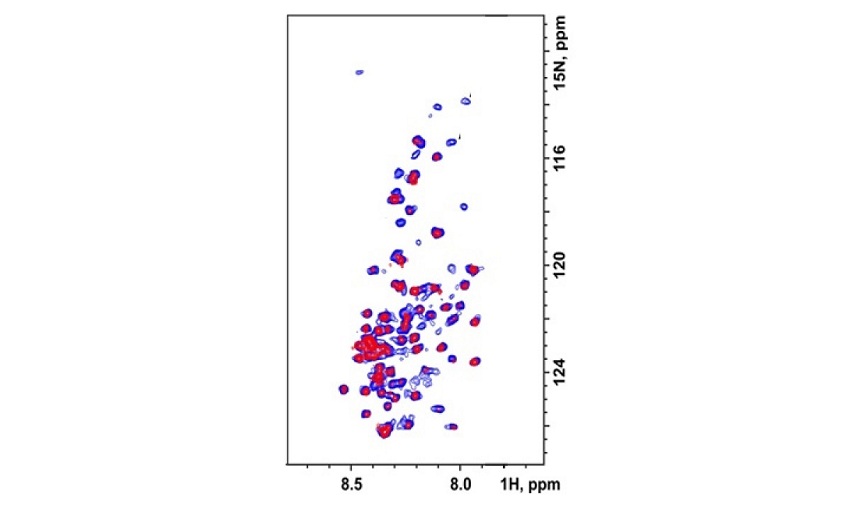
Исследователи СПбГУ создали новую теорию диффузионных экспериментов ЯМР для изучения амилоидных фибрилл — ключевых факторов, провоцирующих различные формы деменции, включая болезнь Альцгеймера. Взяв теорию за основу, исследователи показали, что с помощью диффузионного фильтра можно разделять спектральные сигналы фибрилл и других компонентов амилоидогенного образца и получать их индивидуальный спектр. Долгое время это считалось невозможным. Статья с результатами исследования опубликована в одном из самых престижных научных журналов по химии Angewandte Chemie.
Болезнь Альцгеймера — это распространенное нейродегенеративное заболевание, при котором происходит постепенная гибель нейронов, как следствие, возникает деменция. Точный механизм и причины развития расстройства пока не открыты, но известно, что в мозге больных происходит образование амилоидных бляшек. Бляшки состоят из амилоидных фибрилл — особых нитевидных образований, формируемых амилоидными белками.
«Число больных с нейродегенеративными расстройствами в будущем будет расти. Благодаря успехам человечества в лечении рака и сердечно-сосудистых заболеваний все большее количество людей доживает до 80 лет. В этом возрасте риск развития нейродегенеративных расстройств, в том числе болезни Альцгеймера, становится очень высоким. Лекарств от этих заболеваний, к сожалению, до сих пор не найдено», — рассказывает один из авторов исследования Николай Скрынников, заведующий лабораторией биомолекулярного ЯМР СПбГУ, профессор, PhD.
По его словам, в структурных особенностях амилоидных отложений ученые разобрались совсем недавно. Но более детальное изучение процесса амилоидогенеза связано с рядом препятствий. В частности, потому, что в тканях мозга амилоидные фибриллы сосуществуют с другими структурными формами амилоидогенного белка — мономерами, протеолитическими фрагментами и различными олигомерами, часть из которых служит «зародышами» для построения новых фибрилл.
Анализировать такую смесь довольно тяжело, так как, например, при исследовании методом ядерного магнитного резонанса (ЯМР) получается множество спектров, которые отражают не только интересующие ученых фибриллы, но и другие состояния белка. Поэтому специалисты ищут способы, которые бы позволили разделить спектральные сигналы фибрилл и сопутствующих им других структурных форм.
Наиболее очевидным и простым методом, применимым для этой цели, является так называемый «диффузионный фильтр». Это специальный ЯМР-эксперимент, позволяющий отделять сигналы от тяжелых фибрилл и остальных (более подвижных) компонентов образца.
Но около десяти лет назад ученые из Оксфордского университета опубликовали две статьи, в которых возможность реализации такого фильтра для образцов амилоидных фибрилл была поставлена под сомнение. После этого исследования в данной области прекратились.
«Движение фибриллы можно сравнить со случайным перемещением бревна на поверхности водоема, а движения мономера — с перемещением хвоинки. Исследователи из Оксфорда утверждали, что вращение бревна может оказаться быстрее из-за того, что при повороте линейная скорость на его концах получается достаточно высокой. По этой причине, по мнению авторов, различить разогнавшееся бревно и быструю хвоинку становится невозможным, — объясняет Николай Скрынников, — но это совсем не так».
Ученые СПбГУ проверили выдвинутый оксфордскими коллегами тезис и не только опровергли его, но и создали новую теорию диффузионного эксперимента ЯМР.
Причем исследователи описали суть явления тремя методами: аналитическим — вывели компактную формулу, отражающую результаты эксперимента; численным — решили дифференциальное уравнение с помощью подходящего численного алгоритма; методом Монте-Карло — путем компьютерного моделирования случайных перемещений фибриллы в растворе. В итоге все три метода показали фактически идентичные результаты, подтвердив тем самым верность полученной теории.
Для экспериментальной проверки новой теории был избран белок Sup35, обладающий амилоидогенными свойствами. Большая роль в изучении этого белка принадлежит ученым Университета.
В число первых его исследователей вошли профессор СПбГУ Сергей Инге-Вечтомов, а также его ученики и последователи. Используя Sup35 в качестве модельной молекулы, команда исследователей из лаборатории биомолекулярного ЯМР СПбГУ совместно с учеными кафедры генетики и биотехнологии СПбГУ на практике доказала, что использование диффузионного фильтра в образцах, содержащих амилоидные фибриллы, возможно. Исследователям удалось получить спектр фибрилл, «очищенный» от прочих спектральных сигналов.
«20–30 лет назад ученые слабо понимали, что происходит в мозге человека при наступлении деменции. Постепенно знания накапливались, появлялись новые методы исследования. С их помощью сейчас мы знаем о существовании амилоидных отложений и имеем достаточно детальное представление об их структуре, — отмечает Николай Скрынников. — Наша теория и ее доказательство — это вклад в массив фундаментальных знаний, на который опираются медицинские химики, когда ведут поиск новых лекарств. Предложенный нами диффузионный фильтр для экспериментов ЯМР в амилоидогенных системах сможет в будущем помочь в этом поиске».
Для информации:
В исследовании участвовали:
- постдок, научный сотрудник лаборатории биомолекулярного ЯМР СПбГУ Борис Харьков
- заместитель руководителя лаборатории биомолекулярного ЯМР Иван Подкорытов
- научный сотрудник кафедры генетики и биотехнологии СПбГУ Станислав Бондарев
- младший научный сотрудник кафедры генетики и биотехнологии СПбГУ Михаил Белоусов
- аспирант кафедры ядерно-физических методов исследования СПбГУ Владислав Саликов
- профессор кафедры генетики и биотехнологии СПбГУ Галина Журавлева
- руководитель лаборатории биомолекулярного ЯМР СПбГУ, профессор Николай Скрынников