Ученые СПбГУ исследуют пептид, потенциально способный заблокировать коронавирус
Для вторжения в клетки человеческого организма коронавирусы, в том числе и SARS-CoV-2, используют так называемые шипы
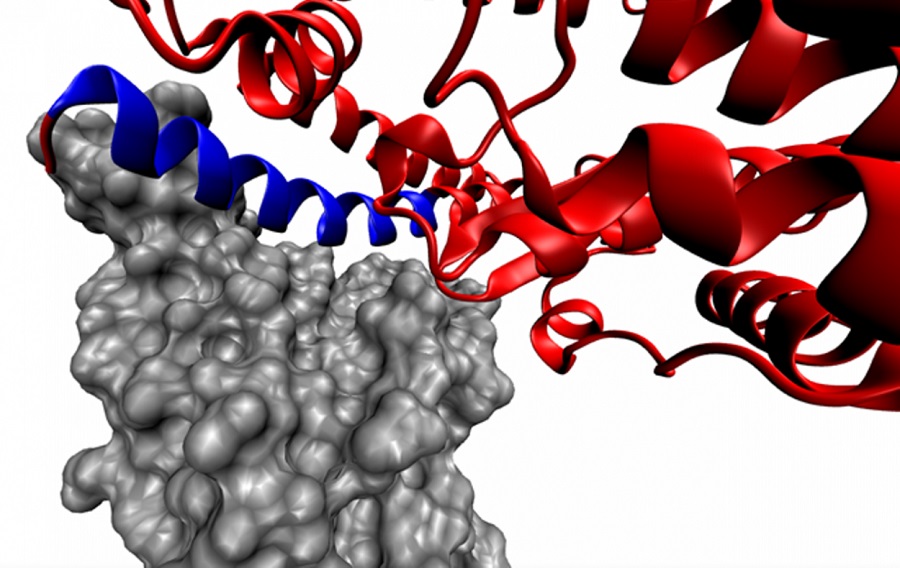
Группа ученых Санкт-Петербургского университета, Института цитологии РАН и Университета Цинхуа (КНР) начала исследовать пептид, потенциально способный заблокировать связывание коронавируса SARS-CoV-2 с клетками человека. Если эксперименты окажутся удачными, то в будущем пептид можно будет использовать для создания лекарства от COVID-19.
Для вторжения в клетки человеческого организма коронавирусы, в том числе и SARS-CoV-2, используют так называемые шипы. С помощью этих «шипов», образуемых на поверхности вируса специальным белком, вирус стыкуется с человеческой клеткой.
Для стыковки используется один из многочисленных типов белков-рецепторов на поверхности человеческой клетки. В случае с SARS-CoV-2 это ангиотензинпревращающий фермент 2 (angiotensin-converting enzyme 2, ACE2).
В конце марта китайские ученые опубликовали кристаллическую структуру этого фермента в комплексе с рецептор-связывающим доменом вирусного белка-«шипа», что позволило исследователям из Массачусетского технологического института (США) идентифицировать фрагмент ACE2, с которым связывается вирус.
Это пептид из 23 аминокислотных остатков (IEEQAKTFLDKFNHEAEDLFYQS). По замыслу создателей пептида, он должен блокировать сайт связывания белка-«шипа», тем самым лишая вирус возможности «стыковаться» с ACE2 и проникать в клетки человеческого организма.
В соответствии с такой интерпретацией авторы назвали свой пептид spike-binding peptide 1 (SBP1). Изучением данного пептида и занялись ученые СПбГУ совместно с коллегами из Цинхуа и Института цитологии РАН.
«Идея создать такой пептид могла появиться только после публикации структуры комплекса ACE2 с белком-«шипом» коронавируса, потому что, только видя структуру комплекса двух белков, можно идентифицировать в составе одного белка небольшой фрагмент, который мог бы связываться со вторым белком», — пояснила сотрудник кафедры биохимии СПбГУ и лаборатории биомолекулярного ЯМР Института трансляционной биомедицины СПбГУ кандидат биологических наук Ольга Рогачева.
При создании пептидов не всегда можно спрогнозировать их физико-химические свойства, и поэтому часто оказывается, что предложенный пептид может неспецифически связываться с другими белками человека или липидами клеточных мембран, то есть делать не только то, для чего он был направлен в организм.
«Пептид с такими свойствами как минимум бесполезен, так как вряд ли доберется до своей мишени. Обычно так ведут себя гидрофобные пептиды. SBP1 не гидрофобен, но мы обязательно будем его проверять на неспецифическое связывание с рядом тестовых белков. Вероятность того, что SBP1 специфически, то есть как ключ к замку, подойдет к какому-то постороннему рецептору и сможет запустить некие непредвиденные процессы в клетке, очень мала, но полностью исключить ее тоже нельзя. Обычно эти эффекты видны уже на стадиях клеточных экспериментов и экспериментов на животных», — рассказала Ольга Рогачева.
Исследования проводятся научными сотрудниками лаборатории биомолекулярного ЯМР СПбГУ Ольгой Рогачевой, Дмитрием Лузиком и Ириной Тюряевой — в том числе на базе ресурсного центра «Магнитно-резонансные методы исследования» Научного парка СПбГУ. Клеточные эксперименты предполагается проводить на базе Института цитологии РАН.
Часть работы в рамках рабочего сотрудничества выполняется в лаборатории профессора Йи Шу в университете Цинхуа в Китае. Руководит проектом заведующий лабораторией био-ЯМР профессор Николай Скрынников.
«Наша лаборатория уже занималась исследованием белок-пептидных комплексов, поэтому у нас есть некоторый опыт решения подобных задач. Сначала мы изучаем связывание пептида с белком «в пробирке» методом ядерного магнитного резонанса и на компьютерной модели методом молекулярной динамики. Главная цель этих экспериментов — доказать, что пептид связывается с нужным нам сайтом на поверхности белка и что это связывание достаточно сильное. Также на этой стадии мы проверяем пептид на способность неспецифически взаимодействовать с другими белками. Если пептид успешно проходит все эти тесты, мы начинаем исследования на клеточных культурах. К сожалению, сейчас из всего спектра методов нам доступно только компьютерное моделирование. Работа в лаборатории в данный момент приостановлена в связи с карантином», — сказала Ольга Рогачева.
На данном этапе исследователи запустили молекулярное моделирование связывания пептида SBP1 с белком АСЕ2 и заказали все необходимое для экспериментов «в пробирке».
Если блокирующие свойства SBP1 подтвердятся, а также удастся доказать отсутствие неспецифического связывания пептида с другими белками, потенциально он может быть использован для создания лекарства от COVID-19.
Причем, как утверждают ученые, даже возможные мутации вируса не должны стать помехой для дальнейшей работы.
«Блокировать вирусные белки — не самая популярная стратегия, потому что вирусы постоянно мутируют и в какой-то момент созданная молекула может перестать связываться с вирусным белком. Но SBP1 вырезан из ACE2 человека, поэтому если из-за каких-то мутаций белок-«шип» перестанет связываться с SBP1, то такой «шип» лишится и способности эффективно связываться с ACE2 и данный штамм SARS-CoV-2 уже не будет опасным для людей. С другой стороны, если когда-то появится новый коронавирус, использующий ACE2 для входа в клетку, то SBP1 будет применим и против него», — отметила Ольга Рогачева.
Чаще всего коронавирусы проникают в организм человека через дыхательную систему. Тем не менее предварительные данные свидетельствуют, что как раз в дыхательной системе ген ace2 экспрессируется слабо.
«Вероятно, с этим связана невосприимчивость большинства людей к SARS-CoV-2. Если же смотреть более детально по отделам дыхательной системы, то максимальная экспрессия гена ace2 обнаруживается в носовой полости, а минимальная в альвеолах легких. Это означает, что у большинства заболевших будет наблюдаться только насморк, а в легких этих людей SARS-CoV-2 размножаться просто не сможет.
-Однако тяжелые случаи COVID-19 говорят о том, что при некоторых состояниях экспрессия гена ace2 в легких возрастает. Тогда размножение SARS-CoV-2 в легких может привести к пневмонии, а в случае неадекватной реакции иммунной системы — и к острому респираторному дистресс-синдрому. Блокирование взаимодействия белка-«шипа» SARS-CoV-2 и ACE2 на ранних стадиях заболевания у таких людей могло бы снизить их уязвимость к вирусу предотвратить тяжелое течение болезни», — уточнила Ольга Рогачева.
Поскольку на начальных стадиях болезни вирус размножается в клетках дыхательной системы и в кровь не попадает, то оптимальными способами доставки SBP1, по мнению ученых, могут стать ингаляционный и интраназальный.
«Целесообразность использования блокаторов взаимодействия белка-«шипа» и ACE2 на стадии острого респираторного дистресс-синдрома надо исследовать отдельно. По моим представлениям, в этом случае большую пользу должны принести регуляторы иммунных реакций», — добавила Ольга Рогачева.
По ее мнению, перспективы стать медикаментом у SBP1 есть, но говорить со 100-процентной уверенностью о нем как будущем лекарстве рано. Однако, отметила исследователь, оптимизм внушают проводимые в настоящее время клинические исследования рекомбинантной немембранной формы ACE2 для лечения COVID-19.
«SBP1, по данным его создателей, лишь немногим уступает ACE2 в связывании белка-«шипа». В то же время, в отличие от ACE2, он не должен участвовать ни в каких процессах в организме человека. В идеале, если все это подтвердится, у SBP1 есть шансы дойти до клинических исследований в качестве недорогого и безопасного лекарства, активного по отношению ко всем коронавирусам, использующим для входа в клетку ACE2.
-К сожалению, в реальности лишь немногим разработкам удается преодолеть весь путь от лабораторных экспериментов до аптечной полки и этот путь занимает очень много времени. Те методы, которые используем мы, позволят однозначно решить, стоит ли начинать с SBP1 эксперименты на животных или нет. На данный момент ответ на этот вопрос действительно актуален», — заключила Ольга Рогачева.